
あの時、バルマー系列の関数式を見たボーア君の閃きが明かされる!!
これは…あの関数式を見てすぐに「ぴん!」ときたなら
やはりボーア君凄過ぎやで~
では、ボーア君の閃きを覗いていきましょう。
◎水素原子の線スペクトル

この水素原子(原子内の電子)が放つ光にどんな法則があるのか?
ここにある関係性を見つけたバルマーによる関数式がこちら
⇓


この4つの波長の間にある関係性=規則性を抽出すると

こうなるわけです。
ホントに規則性あるじゃん、しかも濃い目!
んで、これを見たボーア君の閃きってのは
⇓
水素原子の中で n=3軌道にいた電子がn=2軌道へ移動する時

n=3軌道を回る電子のエネルギー>n=2軌道を回る電子のエネルギー
なので、このエネルギー差分が「光(電磁波)」として放出される。
この光の振動数を計算すると、その値は

バルマー系列の①赤い光の振動数(波長の逆数)とぴたり一致するのです。
つまり、バルマー系列の関数式は電子がどこから⇒どこへ軌道移動した時の光かを
ピタッと示していたわけです。
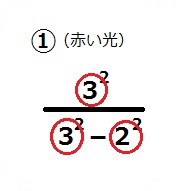
この3と2は「n=3軌道」から「n=2軌道」を示し
なんと「電子の構造」を表してたんです!
そのことにいち早く気が付いたのがボーアだったってことっすな。
つーことは、


②n=4軌道⇒n=2軌道へ遷移するとき、青い光を
③n=5軌道⇒n=2軌道へ遷移するとき、藍色の光を
④n=6軌道⇒n=2軌道へ遷移するとき、紫の光を
放つ、という水素原子の構造~水素原子内の電子の動きと放つ光の関係が見えてくるのです。
だからな、バルマー系列は
”水素原子中の電子がn=2軌道より外側の軌道から⇒n=2軌道に遷移するときに穴つ光”
について示していたってことやな。
それ以外の軌道遷移の時のこと気になるでしょ~
なんでも、『n=2軌道以外の軌道へ遷移する時、電子が放つ電磁波は赤外線や紫外線になるため可視光ではなくなるため肉眼では見られない』んだってよ~
つまり、我々にとって「光」とは認識できなが差のエネルギーは放たれているわけや~

バルマー系列見て、即座にピンときたボーア君はやっぱ天才やな。
ってかマジで驚異や~こんな人と同じクラスで隣の席になってみたかったわぁ。
天才の閃きって凄いよね。
こうやってじっくり見ていくと、その凄さに震えるよね。
こういう飛躍的な思考を身に着け、縄文の智恵を見ていくと更に震えるで~
(つづく)



