
ざっくりと「位置と運動量は同時に確定できない」という解釈で、
先を急ごうと思っていたら~もっと深刻な「曖昧さ=不確定性」だった~
縄文の数学・古代の智恵を理解する為に、先に量子論の世界へ寄り道中の私です。
無知な私に量子論の世界を優しく案内してくれる良書がこちら
⇓
では、1927年に発表されたハイゼンベルクの「不確定性原理」を見ていこう。
⇓
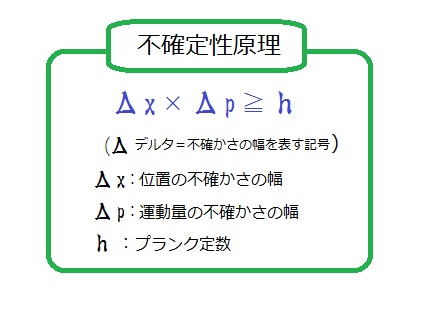
ある物質に関する「位置」と「運動量」を測定する時、両者を同時に1つの値に確定することはできず、避けられない「不確かさ」が残る。
→ミクロの世界には逃れられない「曖昧さ」が存在しており、すべてを確定することはできない!というもの
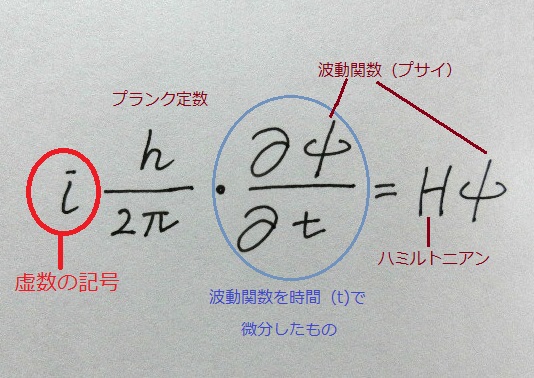
この原理はシュレーディンガー方程式から導かれる結論の1つ、なんだと。
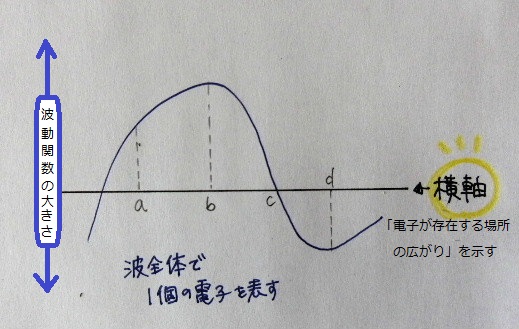
この方程式から「電子の波」を無理くり描いてみるとこんな感じ
⇓
では、ここから「電子の運動量」を確定してみようとすると、
”電子の運動量=電子の質量×速度”
電子の質量は決まっているので「速度」がわかれば電子の運動量を求められるわけだ。

『電子の速度』は、電子の波を「正弦波」に分解した時の1つ1つの波の波長として示される(自然界のあらゆる波は基本的な波「正弦波」を重ね合わせたものになっている)
⇓
だから、ここも無理くり「電子の運動量」を確定してみる、すると…
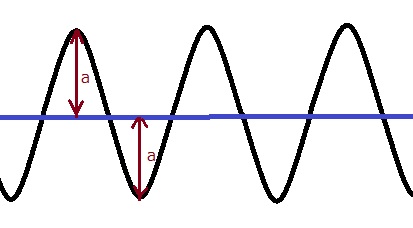
電子の運動量(速度)を1つに確定する=電子の波は1つの正弦波で示される
この時!
波の横方向に無限に広がって”位置が確定しない” ことになる
では、今度は「位置を確定」してみると、
⇓
位置を1つに確定する時の電子の波を再現するには、
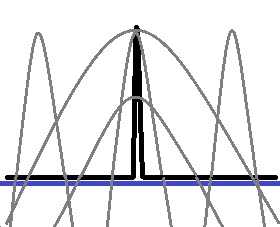
無限の種類の正弦波を重ね合わせる必要があり、運動量(速度)が確定しない…ことになるわけっす。
位置と運動量の「不確かさ」の幅の積は”プランク定数よりも必ず大きくなる”ことも、シュレーディンガー方程式から導き出せる、それが先に示した不確定性原理の式ってわけ。
ここまで見てきて、わかりだろうか?
『不確定性原理』が示しているのは、
- 「✖」-位置と運動量を同時に「誤差なく測定すること」はできない、(のではなく)
- 「〇」-ミクロの物質の性質として、ある時刻(一点)に於ける物質の位置と運動量はただ1つに決まっていない(ということ)
簡潔にまとめると、『物質は常に曖昧な位置や運動量を持つ』と示されたのです!!
そもそも、シュレーディンガー方程式から掴める電子の波の姿も四次元の波を無理くり三次元の波にして見ていた感じだし、位置だって「確率」でしかわからんしね。
我われにとっては「曖昧な姿」でしか捉えられないのでしょう。
「i」を持つ波を正確にとられることができたら、もっと正確に「ありのまま」の世界の姿を見ることができるんだろうか??
そもそも電子は1個の状態の時「粒子状」なのだろうか?
(つづく)


